ИСПОЛЬЗОВАНИЕ МЕТОДА ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В КЛИНИКО-ДИАГНОСТИЧЕСКИХ ЛАБОРАТОРИЯХ
Внедрение метода полимеразной цепной реакции (ПЦР) в лабораторную практику стало одним из наиболее важных событий в клинической лабораторной диагностике в последнее десятилетие. Метод ПЦР поднимает диагностику на принципиально иной уровень - уровень определения ДНК или РНК,что позволяет провести прямое обнаружение инфекционного агента или генетической мутации. С помощью ПЦР одна молекула ДНК может быть обнаружена в присутствие миллионов других молекул ДНК. Возможности ПЦР-анализа образно можно представить себе на примере поиска "иголки в стоге сена".
Идея открытия метода ПЦР принадлежит американскому ученому Кэри Б.Мюллису, сотруднику корпорации "Цетус".Одним из апрельских вечеров 1983 года, сидя за рулем автомобиля, на освещенной луной горной дороге Северной Калифорнии Кэри Б.Мюллиса посетила мысль о процессе, благодаря которому можно получать копии генов в неограниченных количествах в одной пробирке. Этот процесс он назвал полимеразной цепной реакцией (ПЦР). Ему удалось осуществить его в эксперименте и в скором будущем этот метод стал одним из самых удобных и совершенных среди других методов ДНК-диагностики. С тех пор произошли существенные усовершенствования ПЦР-технологии как за рубежом, так и в нашей стране.
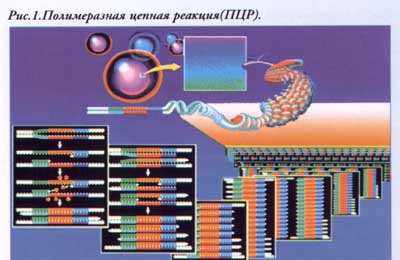
В настоящее время ПЦР представляет процесс, протекающий в одной пробирке и состоящий из повторных циклов амплификации (размножения, копирования) специфической последовательности молекулы ДНК с целью получения достаточно большого количества копий, которые могут быть выявлены обычными методами детекции. Одним из ключевых компонентов реакции являются "праймеры"- синтетические олигонуклеотиды, состоящие из 20-30 оснований, комплементарных "сайтам "(участкам) отжига (присоединения) на идентифицируемой матричной ДНК. На рис.1 представлено схематическое изображение ПЦР.
Каждый цикл ПЦР состоит из трех стадий, протекающих при различных температурах: денатурации, отжига и удлинения. Во время 1 -ой стадии - денатурации, происходит плавление ДНК при температуре 950С, при этом нити ДНК разъединяются и становятся доступными для праймеров. При отжиге ("anneling") реакционная смесь охлаждается до температуры, оптимальной для присоединения "праймеров" к сайту нити ДНК. Праймеры присоединяются в направлении с 3 конца цепочки ДНК, как правило, по одному на каждую цепь. Следующая стадия - удлинение новой цепочки ДНК посредством присоединения имеющихся в реакционной смеси коротких нуклеотидов по принципу комплементарности. Удлинение начинается от праймеров и катализируется ферментом ДНК-поли-меразой при оптимуме температуры 72°С. ДНК-полимераза, используемая в современных методиках - Tag- полимераза, выделенная из термостабильной бактерии Termus aquaticus, живущей в горячих источниках, высоко стабильна и сохраняет активность до конца процесса амплификации. Ранние версии ПЦР требовали добавления новых порций нетермостабильных ДНК-полимераз после этапа денатурации ДНК. Tag- полимераза вводится в реакционную смесь однократно. Проведение этапов отжига и удлинения при высоких температурах значительно снижает риск неспецифической амплификации.

Полимеразная цепная реакция протекает автоматически в программируемом термостате - термоциклере (амплификаторе). Трехступенчатый цикл, в результате которого получаются точные копии идентифицируемого участка матричной ДНК, повторяется 30-30 раз в соответствии с заданной программой термоциклера. С каждым новым циклом число молекул матричной ДНК удваивается, по завершении процесса количество копий нарастает в геометрической прогресии (рис. 2). Так, если один цикл продолжается менее 3 минут, то менее чем через 2 часа можно получить около миллиарда копий определяемой последовательности ДНК. Во время первого цикла удлинение новой цепочки от прай-мера заканчиваетсяя произвольно (рис. 3).

Начиная со второго цикла, в смеси накапливаются специфические продукты амплификации, так называемые "ампликоны", ограниченные по длине двумя "праймерами". Именно этот продукт реакции используется для дальнейшей стадии детекции.
В большинстве случаев проводимой в научных лабораториях ПЦР, а также в коммерческих отечественных наборах реактивов в качестве метода детекции используется электрофорез, с помощью которого производится разделение амплифицированного материала по размеру ампликонов. Другие методы детекции основаны на идентификации меченых компонентов реакции. Так в тест-системах фирмы "Хоффманн-Ла Рош", являющейся мировым лидером применения метода ПЦР в медицине, используются праймеры, меченные биотином, соответственно меченным оказывается и продукт реакции амплификации ампликон. На стадии детекции биотин прочно связывается с авидином, входящим в состав коньюгата с ферментом пероксидазой хрена. Далее так же, как при иммуноферментном анализе, добавляется хромоген ТМБ и субстрат перекись водорода для проведения ферментативной реакции, протекающей с изменением окраски раствора. Реакцию останавливают добавлением серной кислоты. Интенсивность окраски измеряют на плашечном фотометре при 430 нм. Развитие окраски, имеющее место только при образовании ампликон-биотин-авидин-ферментного комплекса, прямо свидетельствует о том, что фрагмент матричной ДНК был амплифицирован посредством ПЦР, и соответственно вирус или другой выявляемый агент присутствует в исходном материале.
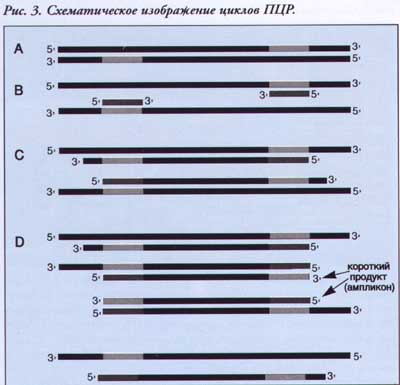
В первом цикле двунитевыеДНК-мимени используются как матрицы с сайтами связывания праймеров; сайты показаны наклонными линиями (А.) Праймеры показаны скрещенными линиями в положении места от^сига в ориентации 5 '-3' (В). При этом ориентация 3 '-концов каждого праймера навстречу друг другу (С). После первого цикла (С) синтезируются две новые нити, на одних концах которых расположены праймеры, а на других "лохмотья" нити ДНК различной длины. Во втором цикле каждая из четырех нитей ДНК, изобра^сенная на схеме С, отрешается с праймерами (которые присутствуют в избытке), чтобы инициировать новый раунд синтеза ДНК (О). Из восьми однонитевых продуктов две нити ограничены только праймерами по длине - это короткие последовательности или ампликоны, которые будут накапливаться экспоненциально в последующих циклах.
Данный метод детекции дает объективную оценку анализа в виде значений оптической плотности, что позволяет использовать его не только для качественного, но и для количественного определения ДНК или РНК. Так, фирма "Хоффманн-Ла Рош" предлагает тест-системы для качественного и количественного определения ДНК ВИЧ 1, РНК вируса гепатита С, в разработке - ДНК цитомегалови-руса и вируса гепатита В. Особое значение возможность количественного определения вируса приобретает при проведении специфической противовирусной терапии.
Одним из существенных преимуществ метода ПЦР является вы сокая чувствительность. При этом следует различать аналитическую и диагностическую чувствительность. Аналитическая чувствительность представляет собой то минимальное количество копий ДНК или РНК в одном миллилитре раствора образца, которое может быть определено данной тест-системой. Так, например, тест-система на гепатит С "Ампликор" фирмы "Рош" позволяет обнаружить от 1000 копий РНК вируса гепатита С в 1 мл образца. Чувствительность тест-системы ВИЧ1 "Ампликор" составляет 480 копий ДНК в 1 мл образца. Диагностическая чувствительность оценивается в процентах и определяет количество пациентов с данным заболеванием, дающих истинно положительные результаты при использовании конкретного набора. Для наборов "Ампликор" фирмы "Рош" диагностическая чувствительность составляет от 95 до 100%.
Диагностическая специфичность ПЦР тест- систем, определяемая процентом здоровых людей, имеющих истинно отрицательные результаты анализа, также достаточно высокая. Для ПЦР-наборов "Рош" она оценивается в 99-100%. Возможности, заложенные в ПЦР анализе, позволяют достичь непревзойденной аналитической специфичности, показывающей отсутствие перекрестных реакций со сходными микроорганизмами или другими агентами. В тест-системах "Рош" высокая специфичность обеспечивается не только специфической амплификацией, но и дополнительной стадией гибридизации с помощью специфических ДНК-зондов. Эти зонды представляют собой короткие фрагменты ДНК, олигонуклеотиды, комплементарные участку, расположенному в середине ампликона. Иммобилизованный на дне лунки планшета ДНК-зонд идентифицирует ампликон, одновременно повышая специфичность выявления ДНК-мишени.
Диагностическая чувствительность и специфичность ПЦР сопоставимы, а зачастую и превосходят таковые, обеспечиваемые культу-ральным методом, называемым "золотым стандартом" для инфекционных заболеваний. Если учесть продолжительность процедуры выращивания культуры клеток (от нескольких недель до месяцев), то преимущество метода ПЦР становится несомненным. Получение результата ПЦР-анализа происходит в течение одного рабочего дня.
При работе методом ПЦР в лаборатории специалист сталкивается с целым рядом проблем: ложноположительные результаты из-за контаминации, сверхчувствительность (когда обнаруживается крайне малое количество патогенных микроорганизмов у пациента без клинических проявлений), проблемы мониторинга лечения (поскольку могут выявляться не только живые, но и погибшие микробы), наличие ингибиторов ПЦР в образце и др. Из всех этих проблем наиболее существенное значение имеет в лаборатории контаминация компонентов реакции и инструментария ранее амплифицированным материалом. Поэтому при проведении ПЦР анализа требуется территориальное разделение выполнения отдельных процедур в лаборатории на 3 зоны. Первая зона предназначена для приготовления и розлива ПЦР-реактивов. Во второй зоне производится выделение образца ДНК из биологического материала, в ней располагаются центрифуга, термоблок или водяная баня, встряхиватель "вортекс", ламинарный шкаф и возможно другие приборы, необходимые для выделения в зависимости от того, какие наборы используются.
Любая новая реакция амплификации начинается с работы фермента N-урацилгликозилазы, оптимум действия которого 35°С. При этом разрушаются синтезированные ранее копии, которые могли контаминировать реакционную смесь, а затем реакция протекает по обычной схеме, начиная с денатурации ДНК при температуре 93°С. При этой температуре N-урацилгликозилаза теряет свою активность.
Еще одно интересное решение предлагает фирма "Хоффманн-Ла Рош" для контроля за получением ложноотрицательных результатов по причине ингибирования полимеразной цепной реакции компонентами, находящимися в биоматериале. Суть состоит в том, что в состав ПЦР-набора включен кроме обычных положительного и отрицательного контроля, которые проходят все стадии анализа параллельно с образцами пациента, так называемый внутренний контроль. Матричная ДНК внутреннего контроля вносится в каждую амплификационную пробирку в составе ПЦР-смеси, остальные компоненты и условия среды, в которой протекает реакция амплификации, являются общими для контроля и образца пациента. На конечной стадии детекции получают результат работы внутреннего контроля. Положительный результат свидетельствует об удачно проведенной ПЦР в данной пробирке. Отрицательное значение внутреннего контроля свидетельствует об ингибировании реакции в данном конкретном случае.
Кроме проблем, связанных непосредственно с методом ПЦР, особую актуальность приобретают обыденные проблемы, с которыми лаборатория сталкивается каждый день и которым подчас не придается особого значения: забор биоматериала, его транспортировка, обработка, хранение. Неправильно взятый мазок или мокрота, некачественный образец крови или сыворотки может привести к лож-ноотрицательным результатам, несмотря на безупречно проведенную процедуру анализа.
В ближайшем будущем встанет вопрос о контроле качества результатов анализа на основе ПЦР. Разработка соответствующих программ - вопрос довольно сложный и включает целый ряд аспектов, таких, как сохранность образцов с низким количеством копий мишеней, а также вопрос стандартизация тест- систем. Значение стандартизации ПЦР-анализа заключается в необходимости получения надежных, точных и воспроизводимых результатов. При столь широком разнообразии ПЦР-наборов, предлагаемых на нашем российском рынке отечественными производителями, выдвигается на первый план возможность сравнения получаемых результатов. При этом в качестве стандарта могли бы использоваться наиболее стандартизованные в настоящее время тест-системы "Ампликор" фирмы "Рош".
Основной прибор для проведения реакции амплификации или собственно ПЦР - это термоциклер, другое его название - амплифи-катор. Из зарубежных фирм наибольшей популярностью пользуются приборы фирмы "Перкин-Эльмер" (рис. 6 ), а также "Эппен-дорф" и "Хайбейд".

Разработаны также отечественные амплификаторы фирмами "Циклотемп", "Внедрение систем в медицину", "Вектор" и др. Для выделения образца ДНК или РНК в лаборатории необходимо иметь приборы, которые предусмотрены самой методикой и зависят от конкретных тест-систем. Это центрифуги для микропроб объемом 1.3 или 2 мл на 13000 §, водяные бани или термоблоки до 100°С, встряхиватели типа "вортекс", ламинарные шкафы или боксы. Метод детекции определяет приборы, которыми должна располагать лаборатория. Если это электрофорез - надо иметь электрофорети-ческую камеру, источник питания, гели, трансиллюминатор или денситометр. Для метода детекции, используемого в наборах фирмы "Хоффманн-Ла Рош", являющегося аналогом процедуре выполнения иммуноферментного анализа, требуется плашечный фотометр и промыватель. Фирма "Хоффманн-Ла Рош" впервые в мире предложила на рынок автоматический ПЦР-анализатор "Кобас Ампликор" (рис. 7), который позволяет автоматизировать процесс амплификации, детекции и регистрации результатов анализа.
 "Кобас Ампликор" сводит до минимума
выполнение ручных операций:
лаборанту необходимо только
подготовить образец ДНК и добавить
в пробирку реакционную смесь,
используя реактивы "Амп-ликор" фирмы "Рош". Прибор объединяет
семь разичных приборов: термоциклер,
термостат, фотометр, промыватель,
автоматический дозатор, компьютер
и принтер. Наличие в приборе двух
независимых термоциклеров
позволяет одновременно выполнять
два различных теста. "Кобас
Ампликор" обеспечивает
автоматизированный контроль за
температурным режимом
термоциклеров, количеством и
сроками годности реактивов,
внутренний контроль проведения
реакций амплификации и детекции.
Автоматический прибор "Кобас
Ампликор" даст возможность
лабораториям оптимизировать
выполнение ПЦР-анализа и сделать
процесс более легким и быстрым.
"Кобас Ампликор" сводит до минимума
выполнение ручных операций:
лаборанту необходимо только
подготовить образец ДНК и добавить
в пробирку реакционную смесь,
используя реактивы "Амп-ликор" фирмы "Рош". Прибор объединяет
семь разичных приборов: термоциклер,
термостат, фотометр, промыватель,
автоматический дозатор, компьютер
и принтер. Наличие в приборе двух
независимых термоциклеров
позволяет одновременно выполнять
два различных теста. "Кобас
Ампликор" обеспечивает
автоматизированный контроль за
температурным режимом
термоциклеров, количеством и
сроками годности реактивов,
внутренний контроль проведения
реакций амплификации и детекции.
Автоматический прибор "Кобас
Ампликор" даст возможность
лабораториям оптимизировать
выполнение ПЦР-анализа и сделать
процесс более легким и быстрым.
Основные области применения метода ПЦР в медицине - это диагностика и мониторинг лечения инфекционных заболеваний, наследственных и онкологических болезней, типирование тканей, В последние годы больше внимания уделяется разработке тест-систем, относящихся к области инфекционных заболеваний. В таблице приводится перечень бактерий и вирусов, для выявления которых в мире уже имеются либо готовые ПЦР наборы, либо компоненты амплификации.
Таблица, Бактериальные и вирусные патогены, детектируемые омлификацией нуклеиновых кислот.
| Бактерии My cobacterium sp. Mycobacterium tuberculosis Mycobacterium avium-intracellulare Mycoplasma sp. Mycoplasma fermentans Clostridium difficile Enterotoxigenic Escherichia coli Enterohemorrhagic Escherichia coli Vibrio cholerae Shigella sp. Rickettsia sp. Ehrlichia sp. Chlamydia pneumoniae Staphylococcus aureus toxins Bacterial meningitis pathogens Whipples disease-associated bacterium Helicobacter pylori Bacillary angiomatosis agent Comamonas sp. Bacillus anthracis Coliform bacteria Mycoplasma genitalium Campylobacter sp. Actinobacikllus pleuropneumoniae Leptospira sp. |
Вирусы
Herpes simplex virus types I and II Epstein-Barr virus Varicella-zoster virus Human herpesviruses 6 and 7 Human JC virus Human papillomavirus Flaviviridae Hepatitis C virus Hepatitis B virus Retroviridae HIV-I and HIV-2 Influenza virus Human parvovirus B19 Adenoviridae Human adenovirus Rubella virus Hepatitis A virus |
В настоящее время фирма "Рош" располагает следующими ПЦР тест-системами: для качественного и количественного определения РНК вируса гепатита С и ДНК ВИЧ 1, для качественного определения НТ1У 1 и 2 типа, микобактерии туберкулезис, хламидии тра-хоматис, гонококка, энтеровирусов, для НЬА типирования. В перспективе планируются наборы для выявления ДНК вируса гепатита В, цитомегаловируса, возбудителей урогенитальных и респираторных инфекций, генетических и онкомаркеров и др. На российском рынке также широко представлены и отечественные тест-системы и компоненты ПЦР. АО "Внедрение систем в медицину" предлагает широкий набор тест-систем, в основном для диагностики заболеваний, передаваемых половым путем (ЗППП): для определения ДНК хламидии трахоматис, микоплазмы гоминис, уреа-плазмы уреалитикум, гонококка, вируса простого герпеса и цитомегаловируса. Фирма "Литех" кроме тест-систем, предназначенных для диагностики ЗППП, выпускает наборы на туберкулез и гепатиты В и С. В ассортименте продукции фирмы "Ниармедик" имеются тест-системы для диагностики оппортунистических инфекций, гепатитов и др. Кроме продажи тест-систем и оборудования как отечественные фирмы, так и фирма "Хоффманн-Ла Рош" проводят обучение персонала лабораторий и их постоянное консультирование, а также исследование методом ПЦР-анализа образцов пациентов на своих базах.
В связи с широким внедрением метода ПЦР в лабораторную диагностику может сложиться впечатление, что этот метод полностью вытеснит иммунохимические методики (ИФА, ФИА и др.). Однако, данные, получаемые этими различными методами, взаимно дополняют друг друга, и врач-клиницист получает в свое распоряжение информацию о наличии болезнетворного агента, и об имунном статусе. Важное значение приобретает целесообразность и своевременность применения метода ПЦР в диагностике и контроле за лечением заболеваний. Рассмотрим значимость использования метода ПЦР для менеджмента наиболее известных инфекционных заболеваний.
Гепатит С:
- разрешение сомнительных результатов серологического теста;
- диффференциация гепатита С от других форм гепатита;
- выявление острой стадии заболевания по сравнению с перенесенной инфекцией или контактом;
- определение стадии инфицированности новорожденных от се-ропозитивных по НСУ матерей;
- мониторинг терапии, например, рофероном А (количественный метод).
- подтверждение результатов скринингового серологического теста;
- скрининг пациентов с высоким риском;
- разрешение сомнительных результатов по Western Blot;
- исследование на станциях переливания крови пулирован-ных образцов крови и ее продуктов.
- скрининг в популяции с высоким риском;
- обнаружение Chlamydia tr. не только в мазке, но и в моче;
- использование ПЦР метода как альтернативного другим методам, направленным на выявление возбудителя.
Туберкулез:
- быстрое обнаружение источника инфекции;
- быстрое выявление пациентов с высоким риском (например, контактные, ВИЧ-инфицированные);
- возможность быстрой изоляции больных туберкулезом;
- обеспечение эффективной лекарственной терапии;
- раннее выявление случаев рецидивов.
Лаборатория должна определить место метода ПЦР среди других используемых ею методов, принимая во внимание специфику задач, стоящих перед лабораторией и экономические аспекты. Говоря об экономических аспектах, прежде всего необходимо учитывать, что использование дешевых тест-систем или методов может привести к увеличению расходов в целом, так как влечет за собой повторное проведение анализов, дополнительные затраты труда и времени, лишние дигностические и лечебные процедуры, причиняет дополнительное беспокойство пациенту и, что особенно важно, влияет на имидж лаборатории и больницы в целом.